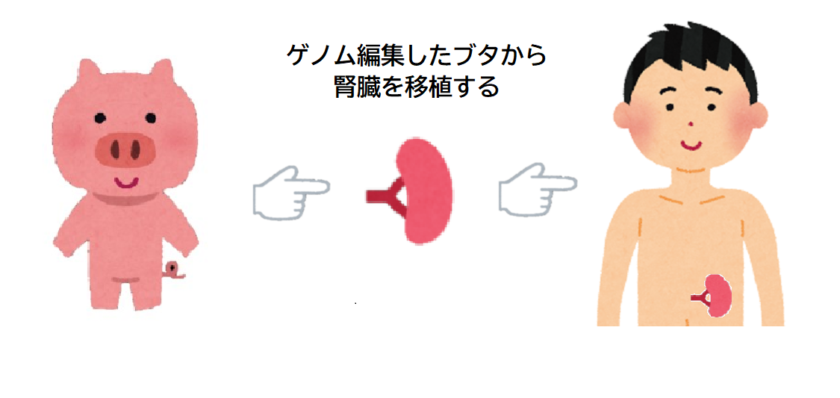
2024年3月16日、生きている人間として初めて、ゲノム編集が行われたブタの腎臓移植を、米国のマサチューセッツ総合病院(MGH)で62歳の男性が受け、4月3日に退院したと発表されました。
ブタの腎臓移植を受けたのは、マサチューセッツ州に在住のリチャード・スレイマンさんという方で、手術が行われた病院は、ハーバード大学医学部の関連病院の中で最大の教育病院として有名なマサチューセッツ総合病院(MGH)です。
スレイマンさんは長年の糖尿病で腎障害を起こし、末期の腎不全に陥っていました。
2018年に一度、死亡した方からのドナー提供を受け、腎臓の移植手術が行われています。
しかし、2023年には移植後の腎は機能しなくなっていたそうです。
このため、人工透析を受けながらもう一度、ヒトからの腎移植を待つという方法もあったのですが、ヒトからの腎移植を受けるには6~7年待つ必要がありました。
ブタの腎臓は、「有害なブタ遺伝子」を除去し、「ヒトとの適合性を向上させるために特定のヒト遺伝子を追加」し、改変したものが用いられています。
この腎臓は、マサチューセッツ州ケンブリッジを拠点とするバイオ企業「eGenesis – イージェネシス」が制作したものです。
ブタの腎臓は移植できるのか
豚の臓器が、人間への臓器移植に最も適していると考えられています。
その理由として
1:サイズと機能
豚の臓器は、サイズや機能が人間の臓器に非常に良く似ているため
2:DNAの類似性
豚は人間と約95%のDNAを共有しているため、遺伝子編集が比較的容易であること
3:感染症のリスク
サルなど霊長類の臓器からはAIDS(後天性免疫不全症候群-エイズ)のリスクがあるが、豚の臓器からはそのリスクが低いとされていること
4:倫理的な問題
食用として豚を飼育することが昔から行われているため、豚の臓器を使用することに対し、倫理的な問題が比較的少ないと考えられている
以上のような理由から、豚の臓器は人間への移植に最も適していると考えられています。
しかし、豚の臓器を人間に移植する際には、拒絶反応や感染症のリスクなどの問題があります。
この問題を解決するためゲノム編集技術を利用し、豚のDNAを改変して人体との互換性を高める研究が行われているのです。
豚以外の動物から臓器移植する研究は、これまでのところ未だないようです。
豚の腎臓を人に移植する際、いくつかリスクが存在しています。
1:感染症のリスク
豚から人への移植は、豚が持っている病原体が人に感染するリスクを持っているため、移植に用いられる豚は特別な管理のもとで、定期的に検査が行われています。
2:拒絶反応
移植された豚の腎臓は、人の免疫メカニズムが異物と認識し、攻撃するため、豚のDNAはゲノム編集技術により改変され、人体との互換性が高まるように工夫されています。
3:長期的な結果は不明
人に移植した後の長期的な結果がまだ良く分かっていません。これからの研究により、詳しく調査する必要があります。
どうやってブタの腎臓を使えるようにするのか
ゲノム編集(または遺伝子編集)とは、生物のDNAを変更する一連の技術のことをいいますが、ブタの遺伝子にゲノム編集を行います。
細胞のDNAに特定の変更を加え、DNA配列を追加、削除、または変更することにより、生物の特性を変えることができます。
ゲノム編集の具体的な方法は以下のようなものになります。

1:特定のDNAを切断
特定のDNA配列を認識し切断するために、ヌクレアーゼと呼ばれる酵素が使用されます。この酵素が、DNAの二重鎖を特定の位置で切断します。
2:DNAの修正または置換
DNAが切断されると、細胞はその部分を修復します。この時、新しいDNA配列を挿入するなどを施して修正することが出来ます。
3:ゲノム編集のツール
ゲノム編集には、有名なCRISPR-Cas9(クリスパーキャスナイン)やZFN(ジンクフィンガーヌクレアーゼ)などのツールが使用されます。簡単に遺伝子を操作できるゲノム編集技術であるCRISPR-Cas9を開発した、エマニュエル・シャルパンティエ氏、ジェニファー・ダウドナ氏は、2020年にノーベル化学賞を受賞しています。
これらのツールを利用し、DNAを特定の位置で切断し、新しいDNA配列を挿入する操作ができます。
ブタの臓器は本来、人体には適合しないため、腎臓を提供するブタに69の遺伝子改変が行われているそうです。
ブタの腎臓を提供した「eGenesis – イージェネシス」という会社は、ゲノム編集技術を利用し、特定のヒト遺伝子を追加したり、いくつかのブタ遺伝子を除去したり、臓器移植を受けるヒトに感染する可能性を持ったブタゲノムに潜伏するウイルスを不活性化したりしています。
また、ドナーとなるブタは、ゲノム編集された胚をクローン化し、子宮へ移植した後に生まれてきたブタを用います。
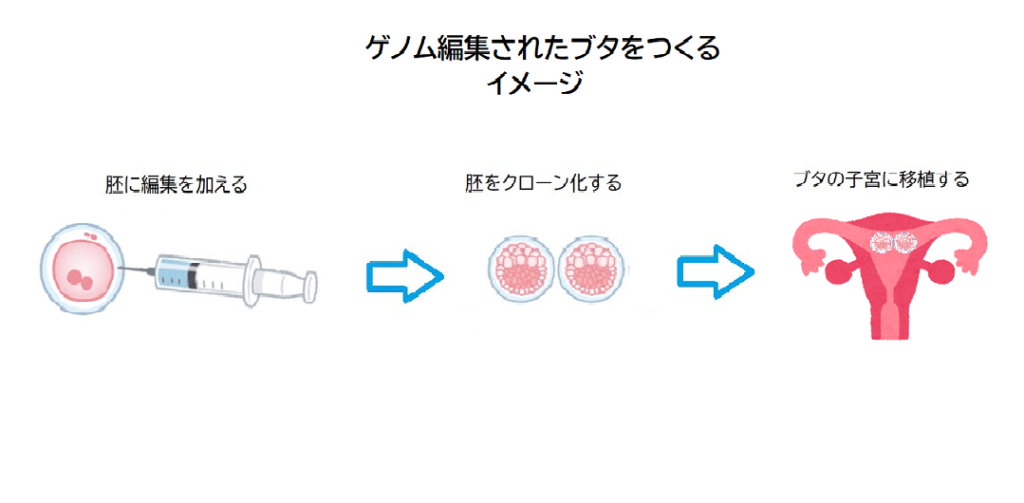
まず、最初に1個のブタの細胞に編集を加える → その編集した細胞から胚が形成される → その胚をクローン化する → クローン化した胚を雌のブタの子宮に移植する → ゲノム編集されたブタの子が誕生する という手順になるわけです。
ブタの腎臓が生きている人間に移植されたのは今回が初めての試みですが、過去にはブタの心臓移植が行われたことがあります。
過去に行われたブタの心臓移植
人の臓器提供者が余りにも少ないという理由から、ブタからの臓器を供給できるよう20世紀末に研究が始まりました。
心臓移植については過去、ゲノム編集されたブタの心臓移植を2人の患者が受けています。
世界初の心臓移植は、2022年1月に遺伝子改変ブタを用いて行われました。
しかし、患者は2か月後に拒絶反応のためではなく、ブタサイトメガロウイルス(PCMV)感染によって死亡しました。
2023年9月にも1名、手術が行われていますが、手術から数週間後に死亡しています。
ブタの心臓移植を受け亡くなった患者は、2人ともヒトの心臓移植を受ける条件に適していないほど重症だったようですので、もともとリスクが高かったのであろうと考えられます。
拒絶反応と感染症との狭間で生きる
臓器移植には拒絶反応が必ずおこります。
移植された臓器が自己ではないため、移植された臓器を免疫細胞が敵だと認識して攻撃するためです。
身体の細胞には、個々に異なる目印がついています。
MHC(Major Histocompatibility Complex)と呼ばれている糖タンパク質で遺伝子をもとに作られています。
このMHCはHLA(Human Leukocyte Antigen:ヒト白血球型抗原)と呼ばれています。
臓器を移植された場合、人間の臓器であっても他人のものであれば、HLAの違いにより移植された臓器が免疫細胞により異物と認識され、排除されてしまうのです。
これがもし、人間ではなくブタからの臓器であれば更にとんでもないことになります。
いくらゲノム編集で遺伝子情報を改変し、人体との互換性が高まるように工夫されているとしても、基本的にヒトとブタという種の違いがあります。
ヒトからヒトでも起こす拒絶反応なのに、異種の臓器移植であれば大変な事態になることは容易に想像できます。
この拒絶反応を抑えるために免疫抑制剤を利用します。
免疫抑制剤の開発によって移植医療は飛躍的に発展してきましたが、最新の免疫抑制剤を使っても、20%ほどの頻度で拒絶反応が起こります。
免疫抑制剤は、「免疫を抑える薬」ですので、免疫力が抑えられてしまうと、細菌やウイルス、カビなど微生物からの攻撃に抵抗する力が弱くなり、感染症を起こしやすくなります。
拒絶反応は移植後の重大な合併症ですので、少なくとも移植後6ヶ月間は多種の免疫抑制剤を多用することになります。
しかし、免疫を抑えるということは、その分だけ感染症を起こしやすくなるため、感染症との戦いが始まります。
免疫抑制剤の投与は、バランスを考慮しなければなりません。
投与量が少なすぎると拒絶反応を起こし、多すぎると感染症を起こすことになります。
時間とともに免疫抑制剤の使用量は次第に減ってきますが、内服が不要になることはありません。
基本的に、生涯内服する必要があります。
ただし、免疫抑制剤にはさまざまな副作用があり、吐き気、食欲不振、下痢、腹痛、口内炎などで苦しむことになります。
しかし、自己判断で免疫抑制剤を止めてしまった場合、せっかく移植された臓器が障害を起こし駄目になってしまうのです。
おわりに
これまで、脳死になった人間に対し、同様なブタの腎臓移植が行われたケースがあります。
移植後、2~3週間で亡くなりましたが、脳死状態の場合は本来、リスクそのものが非常に高く、移植の対象にはならないため、止む得ない結果だと思われます。
今回のように脳死ではない人間に対し、ブタの腎臓移植が行われたのは世界で初めてであり、異種の腎移植後、退院にまで至ったケースはないそうです。
人工透析と腎移植とを比較すれば、圧倒的に移植のほうが優位です。
もちろん、ヒトからの腎移植で比較することにはなりますが、透析の必要がなくなり、時間的な制限や食事制限・水分制限もありません。
また、人工透析と腎移植の予後を比較すると、腎移植の方が確実に長生きです。
5年生存率は、東京女子医科大学によると、透析患者は60%に対して、腎移植患者は98%と報告されています。
また10年生存率は、兵庫医科大学病院によると、透析患者は35.9%に対して、腎移植患者は90%と報告されています。
腎移植には適応があるため、単純に両者の比較はできないと思われますが、もし可能であれば圧倒的に腎移植が優位だといえるでしょう。
現時点でips細胞を利用した医療は、アルツハイマー病や糖尿病、脊髄損傷、肝臓病や腎臓病、白血病、網膜色素変性などの治療が進められています。
また、最近では滲出型加齢黄斑変性の患者へiPS細胞から作った組織(iPS細胞由来の網膜色素上皮細胞のシート移植手術)を用いた治療も行われています。
しかし、腎臓の機能を代償するような組織を作り出すには、まだ遠く及びません。
臓器移植の先進国アメリカでも、腎移植を待っている患者数は年々増加し、腎移植待機中の患者数は1万人以上に上ると推定されています。
日本での腎移植待機患者は、およそ1万3,600人です。
これは、透析を受けながら腎移植を待っている患者数になります。
2022年8月時点で、実際に移植を受けた方は215名です。
そして、移植希望者の待機年数は平均およそ15年といわれ、移植を待ちながら亡くなった方々は6518人に上っています。
人間からの臓器提供が不足するなかで、この「異種臓器移植」が上手く行けば待機患者への受け皿になる可能性があります。
いろいろ倫理的な問題の存在はさて置き、そこに救える生命があるなら、あらゆる手段を使って救いたい気持ちは、皆同じだろうと思います。
今のところ「異種臓器移植」は、恒久的なものとしてではなく、急場の一時凌ぎとして捉えるべきでしょう。
しかし、この方法がもし確立すれば、新たな腎不全への手段として究極の一手になるかも知れません。
加筆:(2024年5月12日)
ブタの腎臓移植を受けたリチャード・スレイマンさんは、2024年5月11日に他界されたと米国マサチューセッツ総合病院から発表されました。
加筆の時点で正確な死因は発表されていませんが、腎移植に関連した原因ではないということです。
謹んでご冥福をお祈りするとともに、スレイマンさんの死を無駄にしないよう、異種腎移植の礎にしなくてはならないと思います。
舘内記念診療所